Histologie
Le plateau d’Histologie est une structure collaborative entre l’Université de Limoges et le service de pathologie du CHU Dupuytren. Les équipements sont répartis entre le CBRS côté hospitalier et la Faculté de Médecine et Phamacie. Il est ouvert à l’ensemble des laboratoires de l’Université de Limoges ainsi qu’aux structures extérieures, qu’elles soient publiques ou privées.
Les techniques d’histologie permettent de mettre en évidence les structures des tissus et des marqueurs spécifiques (ADN, ARN, protéines, glucides, etc.) par le biais de réactifs chromogéniques, fluorescents ou opaques aux électrons pour l’observation optique ou électronique.
Le plateau d’histologie propose un ensemble de techniques applicables en biologie végétale, animale et humaine, en mode autonome pour certains équipements et après formation uniquement ou en mode non autonome avec une prise en charge par le personnel du service de pathologie du CHU.
Sur demande, les médecins du service de pathologie du CHU peuvent également apporter une interprétation histopathologique des résultats obtenus.
Personnels du plateau
Alain CHAUNAVEL
Sandrine ROBERT
L’inclusion en paraffine permet de protéger durablement les prélèvements et de réaliser des coupes microscopiques. Elle consiste à déshydrater les prélèvements fixés et infiltrer les tissus par de la paraffine chaude. Après refroidissement les blocs de paraffine obtenus peuvent être coupés au microtome pour la réalisation de lames (habituellement 3 à 5 µm).
L’infiltration en paraffine est réalisée par un appareil à déshydratation ASP6025 de chez LEICA. La mise en bloc est faite sur un platine d’inclusion de chez LEICA.

ASP6025 Leica : Appareil de déshydratation et d’infiltration de paraffine |
Platine d’inclusion Leica : Préparation de bloc de paraffine |
Les colorations standard permettent de mettre en évidence les principales structures tissulaires et cellulaires (fibres conjonctives, cytoplasme, noyaux, nucléus). Ces colorations, réalisées sur un bac de coloration Tissue Tek de chez SAKURA, accompagnent généralement la création de blocs en paraffine.
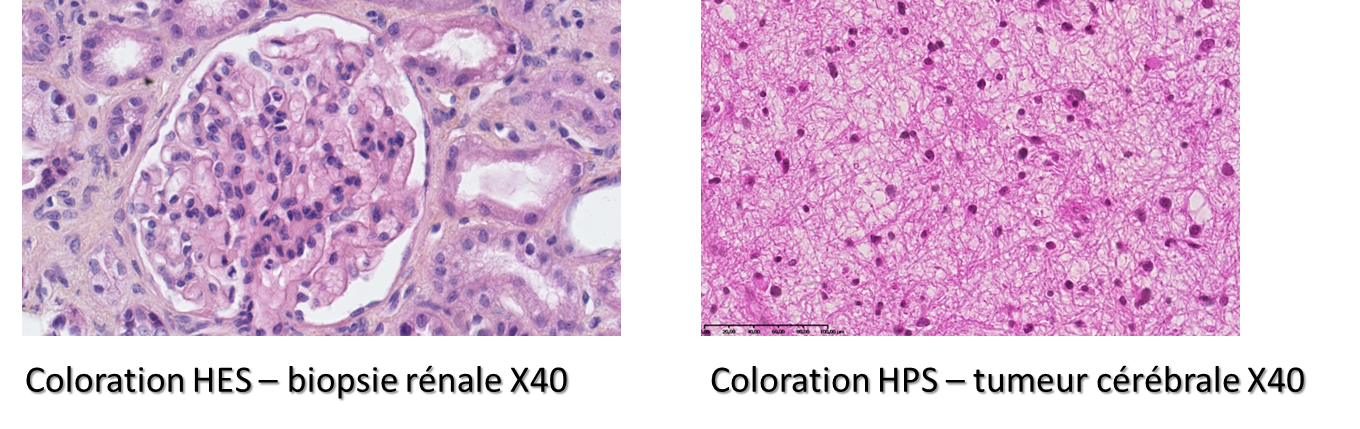 |
 Tissue Tek SAKURA : Automate de colorations standards Tissue Tek SAKURA : Automate de colorations standards |
Le plateau dispose d’un catalogue de plus de 15 colorations spéciales permettant de mettre en évidence différentes fibres conjonctives, les membranes basales, les dépôts d’amylose, les glucides complexes (glycogène, glycoprotéines, glycolipides,) dépôt de Fer (Fe3+) et microorganismes. Elles sont réalisées sur un automate Artisan Link Pro de chez AGILENT.
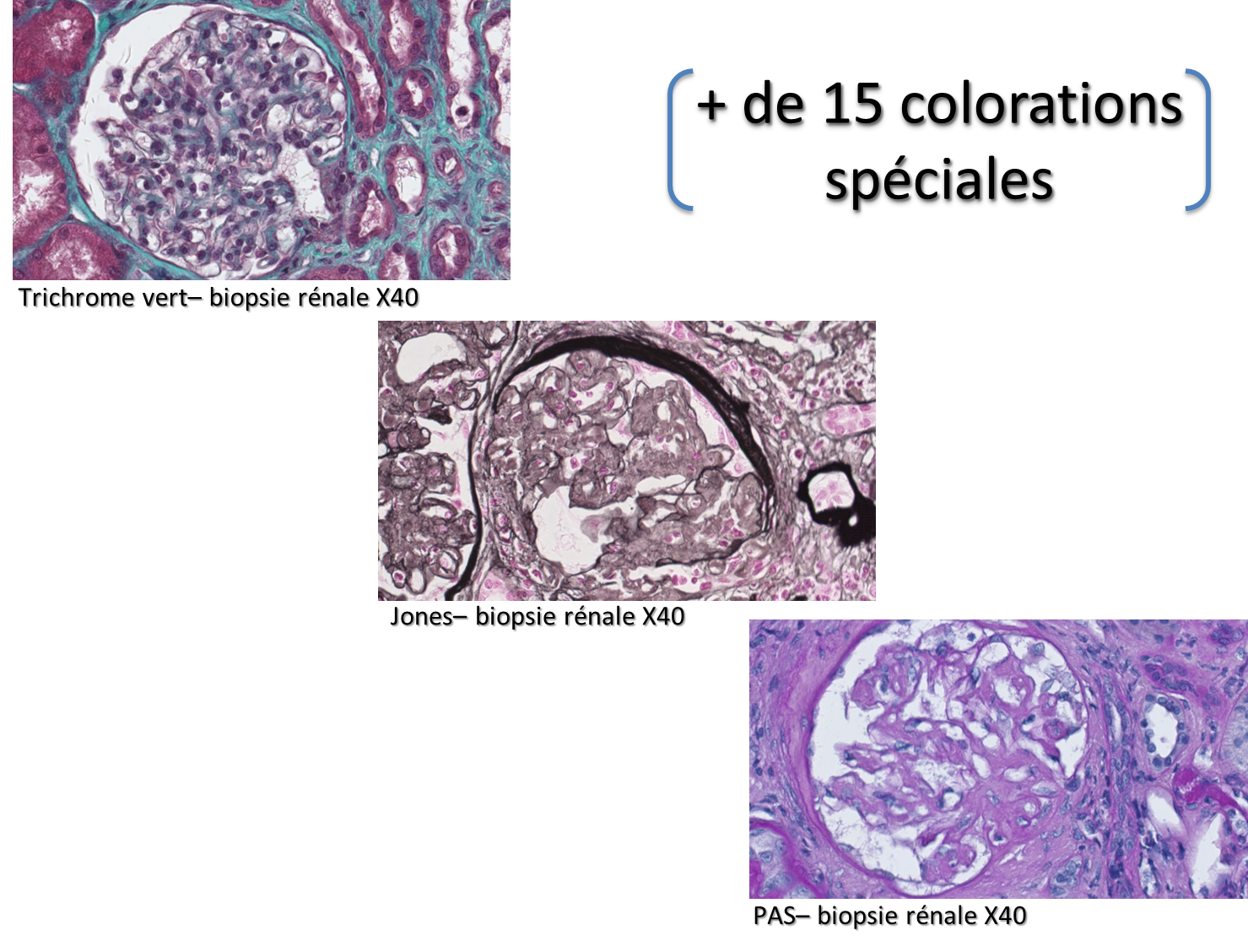 |
 Artisan Link Pro Agilent : Automate de colorations spéciales Artisan Link Pro Agilent : Automate de colorations spéciales |
Le plateau dispose d’un catalogue de plus de 140 anticorps dirigés contre des cibles protéiques humaines directement utilisables en immunohistochimie ou immunofluorescence. Les techniques sont réalisées sur des automates BenchMark Ultra de chez VENTANA.
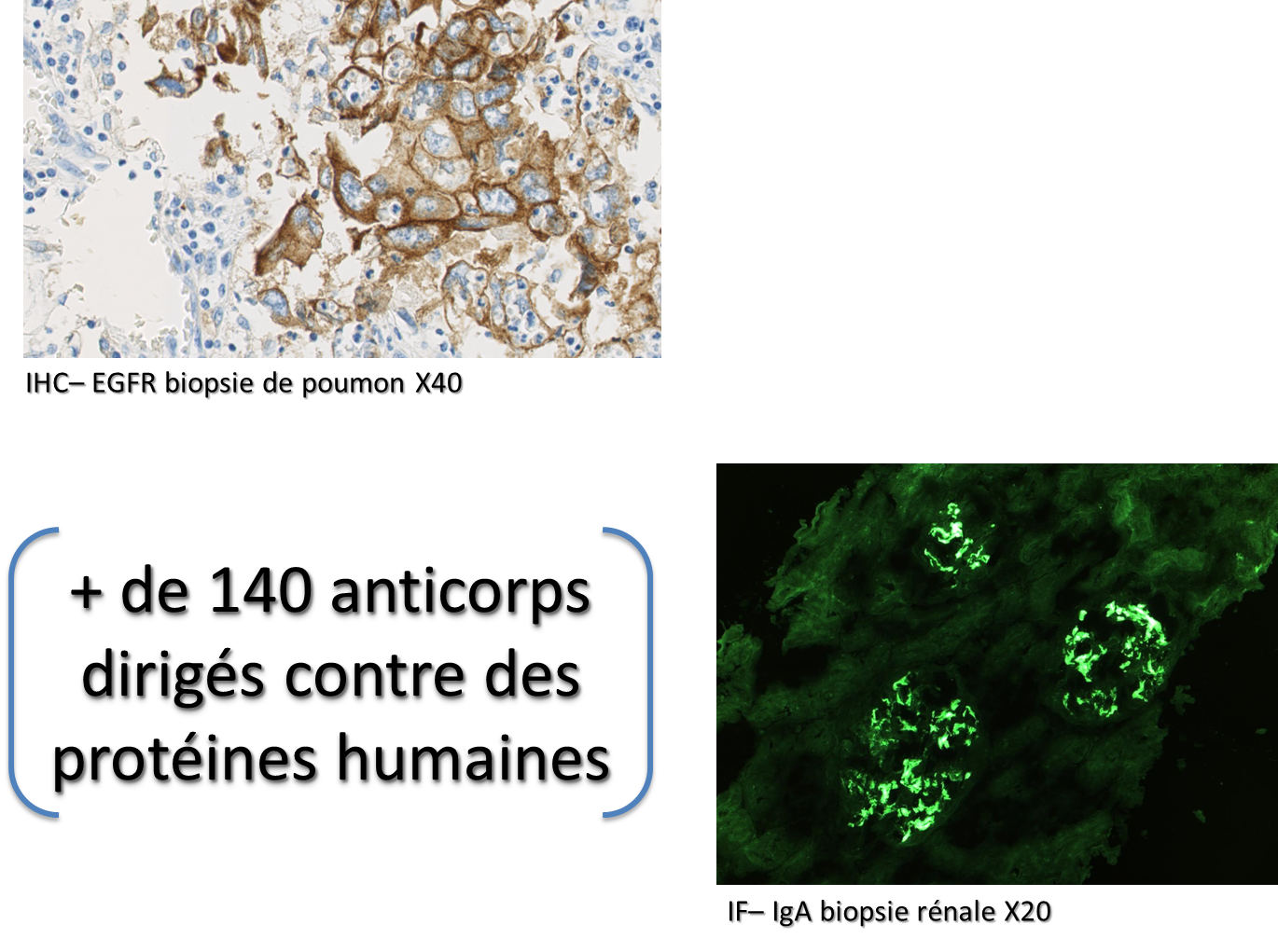 |
 BenchMark Ultra Ventana : Automate d’IHC et IF BenchMark Ultra Ventana : Automate d’IHC et IF |
|
La numérisation des lames colorées permet la conservation des résultats et leurs analyses. Elle est réalisée sur un scanner NanoZoomer RS2.0 de chez HAMAMATSU avec un grossissement x20 ou x40 (jusqu’à x80 en numérique) et la possibilité d’empilement de couches (Z-Stack). Le scanner effectue des numérisations en fond clair et en fluorescence. Pour la fluorescence, le scanner est équipé d’un module de fluorescence avec un jeu de filtres optimisés pour la numérisation des fluorochromes Dapi/Fitc/Tritc/Cy5. Les images peuvent ensuite être visualisées à l’aide du logiciel gratuit NDPView. Ce logiciel offre les possibilités d’un microscope virtuel avec annotation des images, mesures des structures, etc. Les images peuvent être converties en formats TIFF et JPEG. |
 NanoZoomer RS2 Hamamatsu : Scanner fond clair et fluorescence NanoZoomer RS2 Hamamatsu : Scanner fond clair et fluorescence |
La microscopie électronique est l’équipement de choix pour obtenir des images à haute résolution des tissus et des cellules. Des éléments spécifiques peuvent être mis en évidence par des techniques immuno-gold.
Les prestations sont réalisées avec un microscope électronique JEM-1011 JEOL avec un pouvoir de résolution d’environ 4.5 Å. Les images sont enregistrées par une caméra CCD MORADA G3 de 16 mégapixels. Une analyse morphométrique peut être réalisée sur demande.
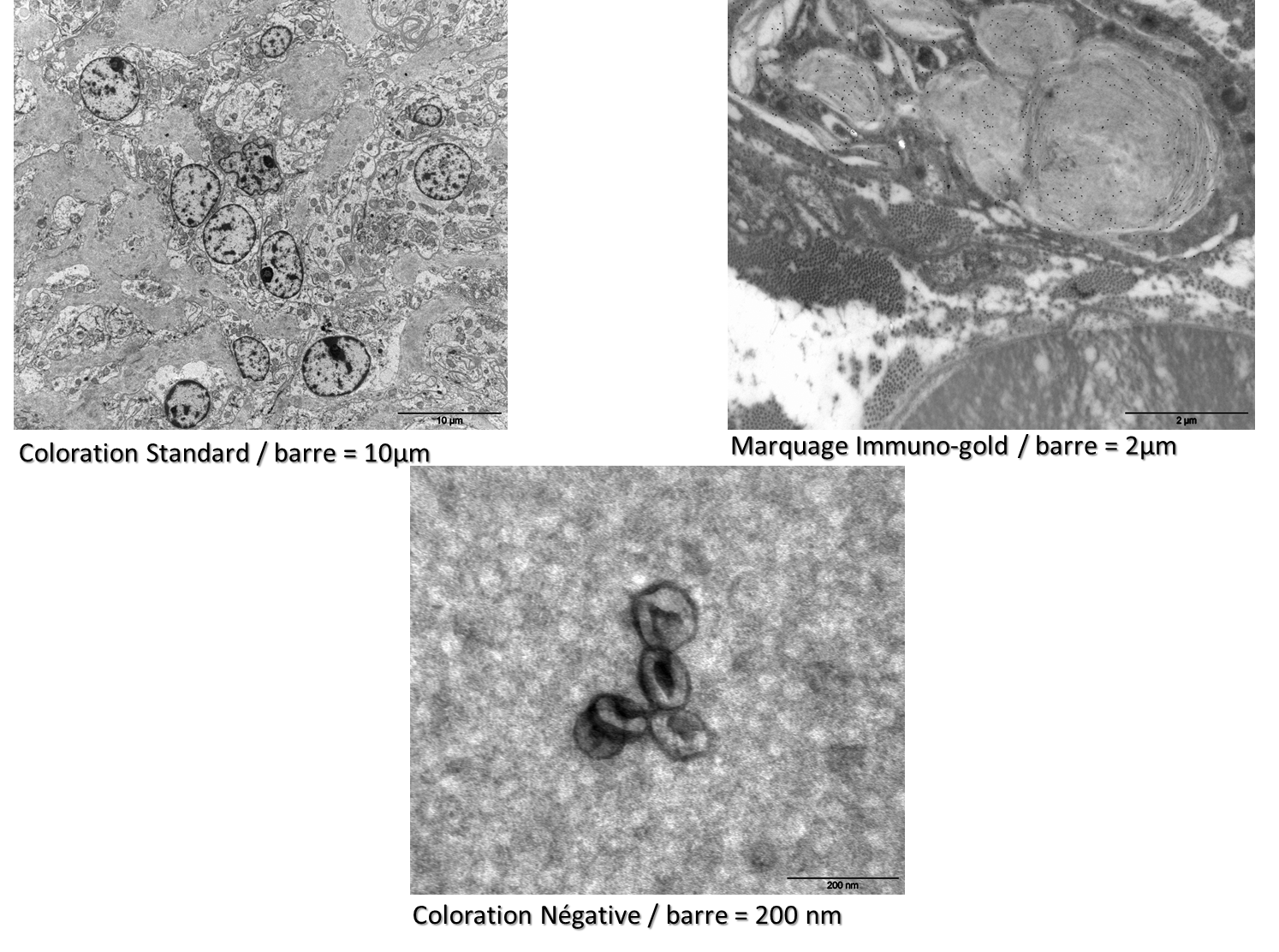 |
 |
| JEM-1011 JEOL : Microscope électronique |
Modalités d'accès
Toute demande d’analyses en mode non autonome doit être effectuée via l’envoi des formulaires à télécharger ci-dessous à l’adresse du plateau biscem.act@unilim.fr. Des recommandations concernant la préparation des échantillons vous seront communiquées.
Les équipements (vibratome, cryostat, microtome, appareil de TMA et scanner de lames) peuvent être utilisés en mode autonome par les demandeurs via une réservation sur site dédié (demandeurs internes) ou en prenant contact avec le plateau (biscem.act@unilim.fr). Avant toute utilisation en mode autonome, une formation sera proposée par l’équipe technique du plateau.
Pour toute demande ou réservation, un code projet vous sera demandé. Si vous n’en avez pas, merci de remplir le formulaire de dépôt de projet (utilisateurs de l’Université de Limoges uniquement). Pour les utilisateurs extérieurs, merci de prendre contact avec BISCEm pour l’attribution de votre code projet.