Modèles cellulaires de neuropathies génétiques à partir de cellules IPs de patients CMT
Dans l’objectif de mettre en place des modèles cellulaires destinés à étudier les voies métaboliques impliquées dans les principales neuropathies périphériques, l’UR20218 a développé un protocole pour obtenir des motoneurones en culture.
Cellules IPs et motoneurones
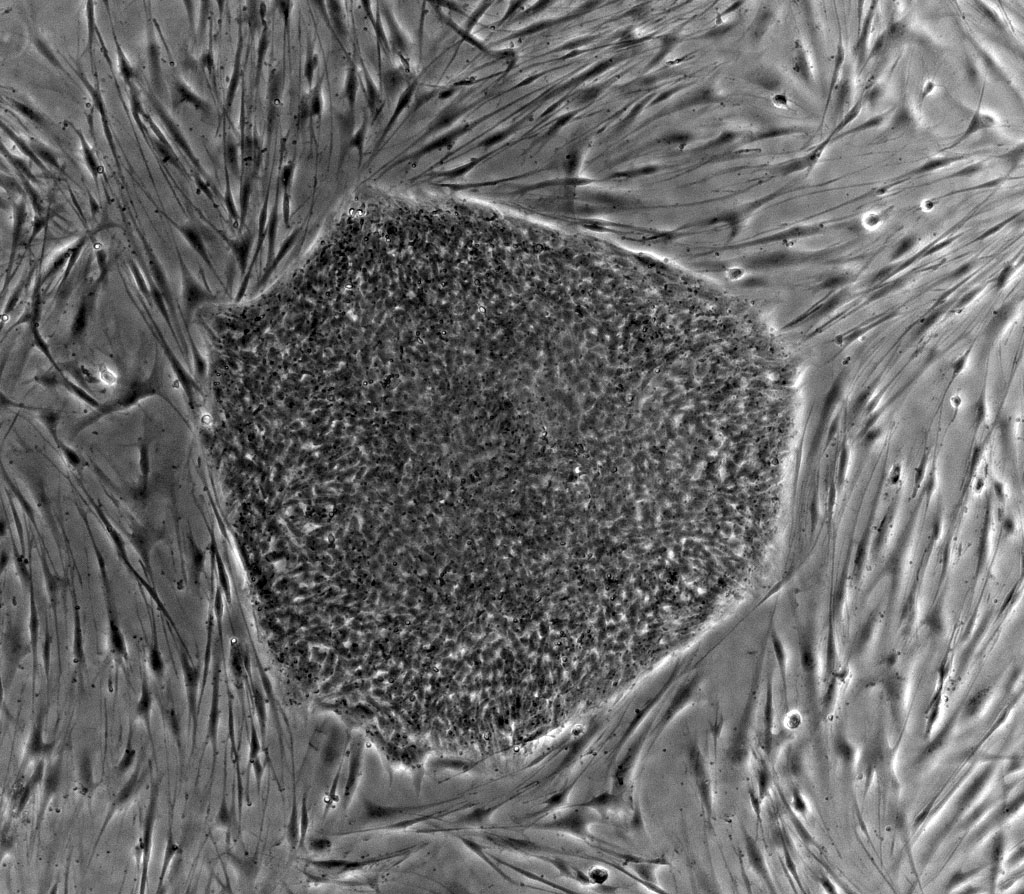
Les neurones périphériques ne sont pas prélevables chez l’Homme, c’est pourquoi il était nécessaire de développer et de proposer un protocole permettant d’obtenir des cellules souches pluripotentes induites ou IPS cells, et de les différencier en motoneurones. L’avantage de cette technique est de pouvoir conserver le patrimoine génétique des cellules originelles servant à obtenir les IPSc.
Ces cellules souches ont deux caractéristiques principales : (i) elles sont capables de s’auto-renouveler indéfiniment, et (ii) elles peuvent donner naissance à plusieurs types cellulaires, elles sont donc pluripotentes. Les IPSc obtenues par reprogrammation in vitro de cellules adultes différenciées, sont donc des cellules similaires aux cellules souches embryonnaires. Les modèles cellulaires ainsi obtenus permettent d’étudier les voies moléculaires impliquées dans la maladie et de contribuer à l’élaboration de nouvelles stratégies thérapeutiques.
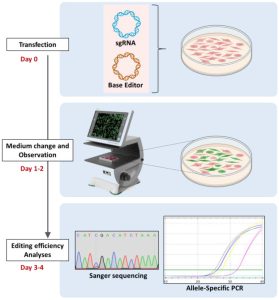
Cellules IPS et CRISPR-Cas9
Plus de 100 gènes et de 1000 mutations associées ont été identifiées comme responsables de la maladie de CMT, ce qui rend sa génétique très hétérogène. De plus, les modèles cellulaires et animaux valides manquent cruellement.
Ainsi, le développement et l’analyse de modèles valides pour la CMT sont devenus essentiels. La création de cellules IPSc à partir de biopsies de patients atteints de CMT ainsi que de témoins sains étant un succès, l’étape suivante, en collaboration avec l’Université de Bordeaux, est donc l’utilisation de la stratégie CRISPR-Cas9 pour introduire différentes mutations dans des gènes cibles tels que GDAP1 et SH3TC2 à partir de hiPSCs de patients témoins.
De ce fait, ces modèles pourront être caractérisés pour mieux comprendre les aspects physiopathologiques de la maladie de CMT, mais aussi créer des modèles isogéniques de cette pathologie.
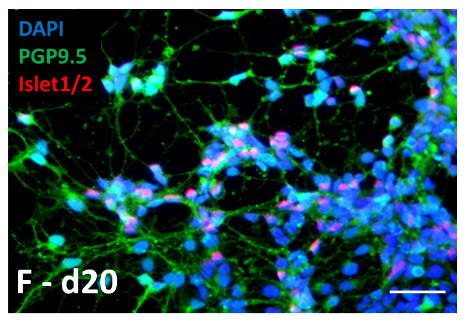
Jonction neuro-musculaire et cellules IPS
Forts de l’expérience des années précédentes, les techniques liées à la mise en place de modèles cellulaires poursuivent leur évolution. La maladie de Charcot-Marie-Tooth (CMT) est divisée en deux sous-type : la forme axonale et la forme démyélinisante, impliquant respectivement les motoneurones (MN) et les cellules de Schwann (SC).
Parmi les 100 gènes altérés qui ont été identifiés comme responsables des CMT, GDAP1 a retenu notre attention puisque les mutations de ce gène sont délétères pour les MNs et/ou pour l’intéraction avec les MNs, les SCs et les cellules musculaires. Ces types cellulaires forment la jonction neuromusculaire (JNM), une synapse reliant l’extrémité terminale du nerf moteur et le muscle, impossible à prélever sur des individus ni même des modèles animaux.
Ainsi, pour étudier avec précision le rôle des altérations de GDAP1 dans les mécanismes physiopathologiques de cette maladie, le projet de créer des JNMs in vitro en utilisant la technologie des IPSc à partir de fibroblastes de patients porteurs d’une mutation délétère de GDAP1 est donc utilisée.
Quelques articles représentatifs
– Advances in modeling the Charcot-Marie-Tooth disease induced pluripotent stem cell derived Schwann cells harboring SH3TC2 variants. Loret et al. Eur J Cell Biol. 2025 Jun;104(2):151485. PMID: 40154263
– From in vivo models to in vitro bioengineered neuromuscular junctions for the study of Charcot-Marie-Tooth disease. Scherrer et al. J Tissue Eng. 2025 Mar 12;16:20417314241310508. PMID: 40078221
– Adressing myelinisation disorders: Novel strategies using human 3D peripheral nerve model. Loret et al. Brain Res Bull. 2025 Mar;222:111252. PMID: 39938756
– CRISPR Base Editing to create potential Charcot-Marie-Tooth diseases models with high editing efficiency: Human induced pluripotent stem cell harboring SH3TC2 variants. Loret et al. Biomedicines. 2024 Jul 12;12(7):1550. PMID: 39062123
– Amlexanox : Readthrough Induction and Nonsense-Mediated mRNA Decay Inhibition in a Charcot-Marie-Tooth Model of hiPSCs-Derived Neuronal Cells Harboring a Nonsense Mutation in GDAP1 gene. Benslimane et al. Pharmaceuticals (Basel). 2023 Jul 21;16(7):1034. PMID: 37513945
– GDAP1 Involvement in mitochondrial function and oxidative stress, investigated in Charcot-Marie-Tooth model of hiPSCs-derived motor neurons. Miressi et al. Biomedicines. 2021 Aug 2;9(8):945. PMID: 34440148
– Optimized Protocol to Generate Spinal Motor Neuron Cells from Induced Pluripotent Stem Cells from Charcot Marie Tooth Patient. Faye et al. Brain Sci. 2020 Jun 27;10(7):407. PMID: 32605002
– New Method for Sorting Endothelial and Neural Progenitor from Human Induced Pluripotent Stem Cells by Sedimentation Field low Fractionation. Faye et al. Anal Chem. 2016 Jul 5;88(13):6696-702. PMID: 27263863